公害防止(大気)大気特論の「排煙脱硫プロセス」に関する覚えるポイントをまとめました
石灰スラリー吸収法(湿式・石灰石‐石こう法)
石炭スラリー吸収法とは
石灰石または消石灰を5~15%含むスラリーで、排ガス中に含まれる硫黄分SO2を吸収し、石こうCaSO4・2H2Oに変えて取り出す脱硫方法
スート分離式とスート混合式がある
スート分離式(別置き酸化方式)
スート分離式とは
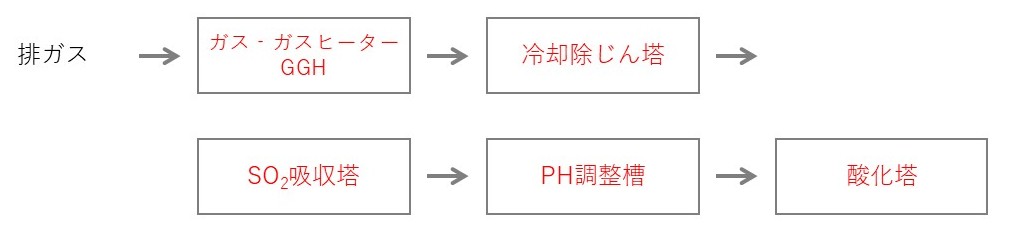
吸収塔の前に冷却除じん塔を設置する
冷却除じん塔で高温の排ガスを吸収に適した温度まで冷却するとともに、ばいじんを除去することで石こう中の不純物混入を少なくする
設備の構成
特徴
pH調整槽で硫酸の添加が必要
各工程の役割と特徴
冷却除じん塔
- 硫黄を吸収しやすくするために排ガスの冷却、ダストの除去
- ばいじんをあらかじめ除去することにより石こうへの不純物混入を少なくする
SO2吸収塔
排ガス中の硫黄SO2と吸収剤中の石灰石CaCO3が反応し、亜硫酸カルシウムCaSO3が生成(pH6)
CaCO3+SO2+$\frac{1}{2}$H2O→CaSO3・$\frac{1}{2}$H2O+CO2
- 洗浄水は腐食性の強い酸性水になる
- pHが酸性側になるとCaCO3スラリーがSO2を吸収してCaSO3・$\frac{1}{2}$H2Oになる反応が進行しづらく、脱硫率が低下する
- pHが塩基側になると脱硫率は上がるが、CaSO3・$\frac{1}{2}$H2Oの溶解度が下がり析出するため、スケールが発生しやすくなる。そのため、過剰の吸収剤が必要となり、石こうの純度が低下する
- 吸収液のpHは6程度の弱酸性~中性にすると、高脱硫率を維持したままスケーリングを防止でき、石こうの純度が高くなる
pH調整槽
- 酸化塔での反応を起こしやすくするため硫酸を添加して、pH4にする
酸化塔
空気中の酸素により亜硫酸カルシウムCaSO3を石こうCaSO4・2H2Oに酸化
CaSO3・$\frac{1}{2}$H2O+$\frac{1}{2}$O2+$\frac{3}{2}$H2O→CaSO4・2H2O
スート混合式(吸収塔酸化方式)
スート混合式とは
吸収塔でSO2とばいじんの除去を同時に行う方法
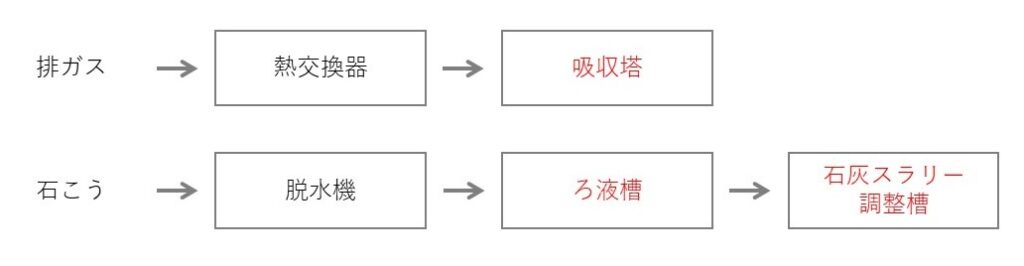
設備の構成
特徴
- 冷却除じん塔が不要、吸収塔で硫酸の添加が不要
- 使用電力量が少ない
- 石灰石の使用量が少ない
- 石灰石過剰率を低く抑えたままで高い脱硫率を達成できる
- 石こうを分離したろ液は再利用できない
- 大気圧に近い条件下で、吸収液中に空気気泡を幅広く分散させる
吸収塔の役割と特徴
- SO2 の吸収とばいじん除去、酸化を同時に行う
- 吸収塔でSO2 の吸収とばいじん除去を同時に行うため、冷却除じん塔が不要
- 酸化反応で生成する硫酸が極めて速く石灰石と反応するため、硫酸の添加が不要
- 生成した亜硫酸カルシウムや最終生成物である石こうが水に溶けないため、スケーリングが問題になる
- 処理ガス中の液滴を除去するため出口近くにデミスターを設置
スケーリング防止策
- 吸収液にあらかじめ石こうの種結晶を加える
- 吸収塔内部は液のよどみの少ない単純構造とし、表面の滑らかな素材を用いる
- 吸収塔下部に滞留時間の長い反応槽を設け、吸収液の石こう過飽和度を常に低い状態に保つ
- 吸収塔内部に乾き箇所や吸収液のよどみが生じないように液分散ノズルを配置し、適切な液ガス比を維持する
- デミスターでは吸収液のよどみと乾き箇所が生じやすいので、運転中の定期水洗により固結を予防
水酸化マグネシウムスラリー吸収法(湿式)
水酸化マグネシウムスラリー吸収法とは
水酸化マグネシウムMg(OH)2を5~10%含むスラリーに二酸化硫黄SO2を吸収させ、空気中で酸化すると、硫酸マグネシウムMgSO4を含む廃液になり、放流する方法。
また、吸収塔から取り出されたスラリーには、亜硫酸水素マグネシウムMg(HSO3)2 や亜硫酸マグネシウムMgSO3が残存。そのまま水域に放流するとCODが上昇するため、空気酸化して硫酸マグネシウムMgSO4にする。
設備の構成

各工程の役割
吸収塔
水酸化マグネシウムスラリーMg(OH)2に二酸化硫黄SO2を吸収させる
SO2 +H2O →H2SO3
H2SO3 +Mg(OH)2 → MgSO3+2H2O
MgSO3 +H2SO3→Mg(HSO3)2
硫酸マグネシウムMgSO3 を含む溶液を吸収塔に返送し、水酸化カルシウムCa(OH)2を加えて水酸化マグネシウムMg(OH)2を再生するとともに石こうCaSO4・2H2Oを回収できる
MgSO3 +Ca(OH)2+2H2O → Mg(OH)2+CaSO4・2H2O
吸収塔下部液
亜硫酸水素マグネシウムMg(HSO3)2 と亜硫酸マグネシウムMg(OH)2を空気酸化して硫酸マグネシウムMgSO4にする
Mg(HSO3)2 +Mg(OH)2 → 2MgSO3 +2H2O
MgSO3 +$\frac{1}{2}$O2 →MgSO4
酸化塔
残存する亜硫酸水素マグネシウムMg(HSO3)2 と亜硫酸マグネシウムMgSO3を空気酸化して硫酸マグネシウムMgSO4にする
Mg(HSO3)2 +O2 → MgSO3+H2SO4
MgSO3 +$\frac{1}{2}$O2 →MgSO4
特徴
- システムが簡単かつ設備費も安価
- 水酸化マグネシウムは石灰石よりも高価なため運転費は高くなる
- 中・小形産業用ボイラーの排煙処理に適している
- 吸収剤の原料は海水と炭酸カルシウム
- スラリーは弱アルカリ性で、毒性・腐食性もなく、取扱いが容易
- 反応後の生成塩の溶解度は水酸化マグネシウムよりも大きく、スケーリングの心配がない
アンモニア硫安法
アンモニア硫安法とは
アンモニア水NH4OHに二酸化硫黄SO2を吸収させ、亜硫酸アンモニウム(NH4)2SO3、亜硫酸水素アンモニウムNH3HSO3 にする
2NH4OH+SO2 →(NH4)2SO3+H2O
(NH4)2SO3 +SO2 +H2O → 2NH4HSO3
特徴
- pH7以上ではアンモニアの損失が多くなり、pH5以下では脱硫率が低下するため、吸収液のpHは6程度にする
- 脱硫反応生成物である亜硫酸アンモニウム(NH4)2SO3、亜硫酸水素アンモニウム吸収液から硫安(硫酸アンモニウム)・石こう・二酸化硫黄を回収できる

コメント